Ciepło właściwe (klasa 7)
Cele:
Dowiesz się od czego zależy ilość popranego przez ciało ciepła oraz czym jest ciepło właściwe.Poznasz jednostkę ciepła właściwego.
Codziennie mamy do czynienia z podgrzewaniem różnych potraw lub gotowaniem wody na herbatę.
Z punktu widzenia fizyki, wiemy już, że w tych procesach zwiększamy energię wewnętrzną potrawy lub wody, a wraz ze wzrostem energii rośnie też ich temperatura.
Czy do zwiększenia temperatury danej substancji o określoną wartość zużywamy zawsze tą samą ilość energii? Rozważmy od czego to tak naprawdę zależy?
Podczas ogrzewania substancji (np. wody) da się zauważyć, że:
1) Przyrost temperatury ΔT jest wprostproporcjonalny do ilości pobranego przez nią ciepła Q
(przyrost temperatury 1kg wody o 2ºC powoduje dwa razy większy pobór ciepła, niż przyrost o 1ºC)
ΔT ~ Q
2) Ilość pobranego ciepła Q jest wprostpoporcjonalna do masy substancji m
(do ogrzania 2 kg wody potrzeba dwa razy więcej ciepła, niż do ogrzania 1kg wody)
Q ~ m
3) Ilość pobranego ciepła Q zależy od rodzaju substancji .
(1kg wody przy ogrzaniu o 1ºC pobierze inną ilość ciepła, niż np. 1kg oleju ogrzany o 1ºC )
Tę własność danej substancji nazywamy jej ciepłem właściwym i oznaczamy c
Łącząc powyższe fakty ciepło pobrane Q przez substancję można obliczyć na podstawie wzoru:

Jednostką ciepła jest dżul [1J]
Przy czym ciepło właściwe c określa ile energii trzeba dostarczyć do 1kg danej substancji,
aby zwiększyć jej temperaturę o 1K (lub 1 ºC ) i jest ono parametrem stałym dla danej substancji
Parametr ten wyznacza się doświadczalnie dla różnych substancji
Można go obliczyć przekształcając powyższy wzór do następującego:
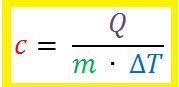
Jednostką ciepła właściwego c jest dżul na
(kilogram razy Kelwin)
![]()
Ciepło właściwe wybranych substancji
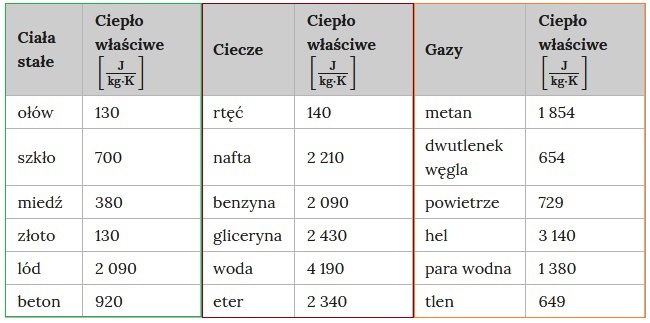
Niskie ciepło właściwe oznacza małą zdolność do magazynowania energii przez substancję
Przykład: 1kg wody ogrzany o 1ºC pochłonie 4190 J energii (ciepła) , a 1kg ołowiu tylko 130 J
4190J : 130 J ≈ 32
czyli tą samą ilością ciepła można ogrzać albo 1 kg wody o 1ºC, albo 1 kg ołowiu o 32ºC
Duża wartość ciepła właściwego wody powoduje, że woda wolno się ogrzewa i wolno stygnie (magazynuje w sobie dużo energii). Fakt ten ma wielkie znaczenie dla stabilności klimatu terenów położonych w pobliżu dużych zbiorników wodnych, prawidłowego funkcjonowania organizmów żywych i nie tylko.
Wyznaczanie ciepła właściwego wody za pomocą czajnika o znanej mocy
W wyznaczaniu ciepła właściwego wody zakładamy, że cała energia elektryczna zasilająca czajnik zostaje przekazana do ogrzania wody (co w tym przypadku nie jest możliwe).
Energię tą można obliczyć mnożąc moc czajnika P [W] przez czas jego pracy t [s]
Moc odczytana przez uczniów wykonujących doświadczenie (filmik) jest błędna - tabliczka znamionowa wskazywała zakres mocy od 1850 W - 2200 W - najbezpieczniej wziąć wartość środkową (2025 W)
[dlatego właśnie wybrałem dla Ciebie ten filmik, aby Cię ustrzec przed podobnymi błędami]
Dane pomiarowe z filmu:
masa wody (1 litr) m = 1kg
czas ogrzewania t = 42,84 s
moc czajnika (około) P ≈ 2025 W [nie 1850 W, jak jest w filmie]
wzrost temperatury wody od 60 ºC do 80 ºC, czyli ΔT = 20 ºC
Obliczamy ciepło właściwe c wody:
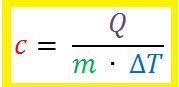
przy czym ciepło pobrane przez wodę równe jest zużytej energii elektrycznej (założenie) Q = P · t
po podstawieniu wszystkich danych do wzoru otrzymujemy
c ≈ 4338 J/(kg ·ºC)
Uzyskany wynik nie wiele odbiega od rzeczywistego c ≈ 4190 J/(kg ·ºC)
Zawyżony wynik może wynikć z tego, że część ciepła ucieka do otoczenia, przyjmujemy średnią moc znamionową czajnika, zaniedbujemy straty w układzie elektrycznym czajnika, dokonujemy pomiaru temperatury, czasu i objętości wody, które mogą być obarczone niewielkim błędem pomiarowym oraz doświadczenie mogło być przeprowadzone w warunkach odbiegających od warunków standardowych.
Więc uzyskany wynik jest naprawdę satysfakcjonujący.
Życzę miłej pracy.